Class 12th Chemistry ( उप-सहसंयोजन यौगिक ) Short Answer Type Question in Hindi Pdf Download Inter Exam 2022
प्रश्न 1. [Ni(CO)4] यौगिक को कैसे तैयार करते हैं ? निकेल की ऑक्सीकरण संख्या क्या है ? इसके मुख्य उपयोग बताएँ।
उत्तर⇒ Ni + 4CO→[Ni(CO)4]
ऑक्सीकरण संख्या Ni = 0
निकेल के शुद्धिकरण में इसका उपयोग होता है।
प्रश्न 2. [Pt(NH3)6]Cl4 ![]() [Pt(NH3)6]4++ Cl– यौगिक CoBr34NH3 2H2O की मोलर चालकता 3 : 1 है। आण्विक और IUPAC नाम लिखें।
[Pt(NH3)6]4++ Cl– यौगिक CoBr34NH3 2H2O की मोलर चालकता 3 : 1 है। आण्विक और IUPAC नाम लिखें।
उत्तर⇒ क्योंकि मोलर चालकता 3 : 1 है इसलिए आण्विक सूत्र [Co(NH3)4 (H2O)2] Br2![]() [Co(NH3)4 (H2O)2]3++ 3Br– ।
[Co(NH3)4 (H2O)2]3++ 3Br– ।
प्रश्न 3. सल्फ्यूरिक अम्ल की तुलना में परक्लोरिक अम्ल क्यों शक्तिशाली होता है ?
उत्तर⇒ HClO4 (परक्लोरिक अम्ल) में क्लोरीन (Cl) की ऑक्सीकल संख्या +7 होती है, जबकि सल्फ्यूरिक अम्ल (H2SO4) में सल्फर (S) की ऑक्सीजन संख्या +6 होती है।
अतः परक्लोरिक अम्ल का ClO3 भाग OH बंध को सल्फ्यूरिक अम्ल की अपेक्षा अधिक आसानी से तोड़कर प्रोटॉन को मुक्त करता है।
प्रश्न 4. निम्न यौगिकों का IUPAC नामकरण करें-
(a) [Zn(OH)4]2-
(b) [CO (NH3)6]2 SO4)3
(c) K2 [Ni(CN)4]
(d) [Co (ONO) (NH3)5]2+
(e) [Ni(CO)4]
(f) K3 [Fe(C2O4)3]
(g) [Pt (NH3)6] Cl4
(h) K4 [Mn(CN)6]
(i) [CO (NH3)4 Cl (NO2) Cl]
उत्तर⇒ (a) Tetrahydroxozincate (II).
(b) Hexammine Cobalt (III) Sulphate.
(c) Potassium tetracyanonickelate (II).
(d) Pentaamine nitrito-O-Cobalt (III).
(e) Tetracarbonjyl nickel (0).
(f) Potassium trioxalao ferrate (III).
(g) Hexaammine platinum (N) Chloride.
(h) Potassium hexacyanomanganate (II).
(i) Tetra amine chloronitrol-N-Cobalt (III) Chloride.
प्रश्न 5. अपचयन से पहले भर्जन की क्या उपयोगिता है ?
उत्तर⇒ लगभग सभी सल्फाइड AG° मान CS2 और H2S से अधिक है। CS2 तथा H2S उफष्माशोषी यौगिक है। इसलिए न तो C तथा न ही H2 सल्फाइड को अपचयित नहीं कर सकता। इसके विपरीत ऑक्साइड के लिए गिब्ज उफर्जा SO2 से कम है। अतः धातु सल्फाइड का ऑक्सीकरण ऊष्मागतिकी रूप से संभव है।
प्रश्न 6. प्रथम संक्रमण श्रेणी के ऑक्सो धातु ऋणायनों का नाम लिखिए, जिसमें धातु संक्रमण श्रेणी की वर्ग संख्या के बराबर ऑक्सीकरण अवस्था प्रदर्शित करती है।
उत्तर⇒ (i) डाइक्रोमेट आयन (Cr2O-27) और क्रोमेट आयन Cr2O4-2 में Cr को ऑक्सीकरण अवस्था (VI) है तथा इसका वर्ग संख्या 6 है।
(ii) MnO–4 अनुचुंबकीय आयन है यहाँ Mn की ऑक्सीकरण अवस्था VI है और इसकी वर्ग संख्या 7 है।
(ii) वन्डेट VO–3 में V की ऑक्सीकरण अवस्था + 5 है वर्ग संख्या भी 5 है।
प्रश्न 7. निम्न में दिए गए यौगिकों के IUPAC नाम लिखें-
(क) [Cu (NH3)4] Cl2
(ख) K4 [Fe(CN)6]
उत्तर- (क) टेट्राएमीन कॉपर (ii) क्लोराइड
(ख) पोटैशियम हेक्सासायनोफेरेट (ii)
प्रश्न 8. निम्न पदों को परिभाषित करें-
(a) लिगेण्ड (b) समन्वयी संख्या और ऑक्सीकरण संख्या।
उत्तर⇒ लिगेण्ड वैसा उदासीन अणु या आयन जो धात्विक आयन को किसी उपसहसंयोजक यौगिक में घेरे रहते हैं, लिगेण्ड कहलाते हैं।
e.g.- [Cu(NH3)4SO4 → NH3 → लिगेण्ड
Na[Ag(CN)2] → (CN) → लिगेण्ड
समन्वयी संख्या- उपसहसंयोजक यौगिक के धातुयी आयन को घेरने वाले लिगण्ड की संख्या ही धातु परमाणु की समन्वयी संख्या कही जाती है।
उदाहरणस्वरूप-
[Cu(NH3)4SO4, समन्वयी संख्या = 4
Na[Ag(CN)2], समन्वयी संख्या = 2
ऑक्सीकरण संख्या- किसी जटिल यौगिक में केन्द्रीय धात्विक परमाणु पर उपस्थित आवेश ही उसकी ऑक्सीकरण संख्या कही जाती है।
उदाहरणस्वरूप- [Cu(NH3)4SO4, ऑक्सीकरण संख्या (Cu-) = + 2
Na[Ag(CN)2], Ag- की ऑक्सीकरण संख्या = + 1
प्रश्न 9. निम्नलिखित उपसहसंयोजक यौगिक के रासायनिक सूत्र को लिखें-
(i) टेट्राहाइड्रोऑक्सो जिंकेट (II)
(ii) टेट्राब्रोमो क्यूपरेट (III)
(iii) पोटैशियम टेट्रासायनोक्यूपरेट (III)
(iv) पेंटा कार्बोनाइल आयन (O)|
उत्तर⇒ (i) [Zn(OH)4]2- (ii) [CuBr4]2- (iii) K2[Cu(CN)4], (iV) [Fe(CO)5].
प्रश्न 10. प्रदत्त जटिल यौगिकों के IUPAC नाम लिखें-
(a) [Pt(NH3)4Cl2] [PtCl4]
(b) [Co(en)2Cl2]2SO4
(c) Na2[CrOF4]
(d) K3[Fe(C2O4)3]
(e) Fe4[Fe(CN)6]3
(f) K[Fe(BF4)]
उत्तर⇒ (a) टेट्राएमीन डाईक्लोरो प्लैटिनम (IV) टेट्राक्लोरो प्लैटिनम (II)
(b) डाईक्लोरोलीस (इथीलिन डाइएमीन) कोबॉल्ट (III) सल्फेट ।
(c) सोडियम टेट्रा फ्लोरो ऑक्सो क्रोमेट (IV) (d) पोटैशियम ट्राई (आक्जेलेट) फॉरमेट (II)
(e) पोटैशियम टेट्राफ्लोरो बोरेट (III)
प्रश्न 11. समन्वय संख्या क्या है ? यह किस प्रकार आयनिक ठोस के त्रिज्या अनुपात से संबंधित है ?
उत्तर⇒ क्रिस्टल में परमाणु एक गोले की सतह माना जाता है तथा किसी परमाणु में पड़ोसी गोले की संख्या को उस परमाणु की समन्वय संख्या कहा जाता है।
अगर संकलन गोलक पर विचार किया जाय तो उनकी समन्वय संख्या 12 होती है। अगर त्रिज्या अनुपात किसी ठोस का अधिक होगी तो समन्वय संख्या धन आवेशित गोले का अधिक होगी।
उदाहरण- अगर r+/r– = 0.414 होगा तो समन्वय संख्या आयनिक ठोस का = 6 उसी प्रकार यदि r+/r– का अनुपात 0.414 से कम हो तो समन्वय संख्या 4 होगा और यदि r+/r– > 0.414 तो समन्वय संख्या किसी आयनिक ठोस का 8 होगी।
प्रश्न 12. आयनिक ठोस के लिए “त्रिज्या अनुपात” और “समन्वयी-संख्या क्या है ? ये दोनों एक-दूसरे से किस प्रकार संबंधित हैं ?
उत्तर⇒ आयनिक ठोस का गोला पड़ोसी परमाणुओं के जितनी संख्या के साथ स्पर्श में रहता है, वही संख्या आयन की समन्वयी संख्या कहलाती है। यह संख्या उस ठोस की संरचना पर निर्भर करता है।
उदाहरणस्वरूप-
साधारण घनाकार संरचना की समन्वयी संख्या = 6
फलक केन्द्रित कार्य की संरचना, समन्वयी संख्या = 12
क्रिया अनुपात- धनायन की त्रिज्या और ऋणायन की त्रिज्या का अनुपात ही त्रिज्या अनुपात कहलाता है।
सबध- त्रिज्या अनुपात का मान जितना अधिक होता है, उतनी ही समन्वयी संख्या भी अधिक होती है।
उदाहरणस्वरूप- त्रिज्या अनपात 10.155 – 0.255); समन्वयी संख्या = 3
त्रिज्या अनुपात (0.225 – 0.414) समन्वयी संख्या = 4
प्रश्न 13. निम्नलिखित पदों की परिभाषा दीजिए-
(i) उप-सहसंयोजक समूह, (ii) केन्द्रीय धातु, (iii) सलग्नी, (iv) दाता परमाणु, (v) उप-सहसंयोजक संख्या, (vi) ऑक्सीकरण संख्या।
उत्तर⇒ (i) किसी उप- सहसंयोजक यौगिक के बड़े कोष्ठक के अन्दर की स्पीशीज को उप-सहसंयोजक समूह कहा जाता है।
(ii) उप-सहसंयोजन समूह में, ऐसे परमाणु या आयन जिन्हें घेरे रहते हैं, केन्द्रीय परमाणु या आयन कहलाता है। जैसे-K4[Fe(CN)3] में Fe3+ केन्द्रीय आयन हैं।
(iii) उप-सहसंयोजक यौगिक में केन्द्रीय परमाणु/आयन से संलग्न अन्य परमाणु या समूह को संलग्नी कहा जाता है। जैसे-K4[Fe(CN)6] में CN– संलग्नी है।
(iv) उप- सहसंयोजक यौगिक के धातुओं में उपस्थित प्राथमिक या आयनन आबंध जो ऋणायनों द्वारा संतुष्ट होते हैं, ऑक्सीकरण संख्या के बराबर होती है। यह संख्या परमाणुओं पर उपस्थित आवेशों के बराबर होता है।
प्रश्न 14. संलग्नियों की दंतिता से क्या अभिप्राय है ? एक एकदंतीय तथा एक द्विदंतीय संलग्नी के उदाहरण दीजिए।
उत्तर⇒ उप-सहसंयोजक यौगिक में उपस्थित परमाणु या परमाणुओं का वह समूह जो केन्द्रीय धातु आयन के साथ संलग्न होता है, संलग्नी कहा जाता है। संलग्नी के परमाणु केन्द्रीय धातु आयन को इलेक्ट्रॉन युग्म प्रदान करते हैं, इसे ही संलग्नियों की दंदिता कहा जाता है।
वैसे संलग्नी जिसमें एक दाता परमाणु हो एकदंतीय संलग्नी, तथा जिनमें दो दाता परमाणु होते हैं, द्विदंतीय संलग्नी कहलाते हैं। H2O एकदंतीय तथा EDTA (NH2-CH2-CH2-NH2) द्विदंती संलग्नी के उदाहरण हैं।
प्रश्न 15. उप- सहसंयोजक यौगिकों में आबंधन की व्याख्या के लिए बर्नर के कौन-सी परिकल्पना दी ? बर्नर सिद्धांत की मुख्य कमियाँ क्या हैं ?
उत्तर⇒ बर्नर द्वारा प्रदत्त परिकल्पनाओं की मुख्य बातें निम्नलिखित हैं- (क) धातुओं में दो प्रकार के आबंध होते हैं, प्राथमिक एवं द्वितीयक । (ख) प्राथमिक आबंध ऑक्सीकरण संख्या तथा द्वितीयक आबंध उप-सहसंयोजक संख्या से संबंधित है। (ग) केन्द्रीय धातु आयन एवं संलग्नी एक-दूसरे के साथ मिलकर त्रिविम व्यवस्था का निर्माण करते हैं, जिसे उप-सहसंयोजक बहुफलक कहा जाता है। (घ) संक्रमण धातुओं के अष्टफलकीय, वर्ग समतलीय तथा चतुष्फलकीय ज्यामिति के आकार के जटिल यौगिक अधिक पाए जाते हैं।
बर्नर सिद्धांत की मुख्य कमियाँ निम्नलिखित हैं- (क) इसके सिद्धांत से यह पता नहीं चलता कि कुछ निश्चित तत्वों में ही उप- सहसंयोजक यौगिक बनाने के गुण क्या हैं ? (ख) उप- संहयोजक यौगिकों के उप-सहसंयोजक समूह में पाए जाने वाले आबंधों में दिशात्मक गुण पाए जाते हैं, इसका कारण पता नहीं चलता। (ग) उप-सहसंयोजक यौगिकों में अभिलाक्षणिक चुंबकीय एव प्रकाशीय गुण का स्पष्ट कारण इनके सिद्धांत से नहीं मिलता।
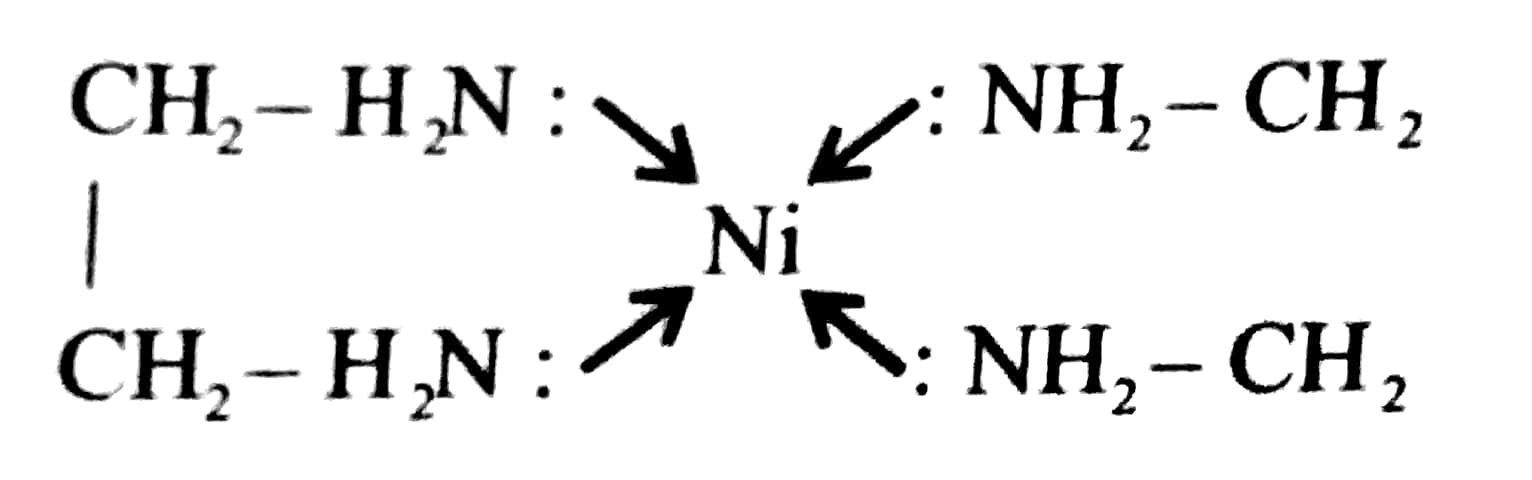
प्रश्न 16. निम्न का क्या तात्पर्य है- (क) किलेटिंग संलग्नी, (ख) उभयदंतीय संलग्नी। विशिष्ट उदाहरण देते हुए समझाइए।
उत्तर⇒ (क) किलेटिंग संलग्नी (Chelating Ligand)-वैसे संलग्नी जिनमें दो या दो से अधिक दाता परमाणु उपस्थित रहते हैं, तथा एक ही केन्द्रीय धातु आयन से जुड़े होते हैं, कलेटिंग संलग्नी कहलाते हैं। जैसे- EDTA (Ethylene Diamine Tetra Acetate) और EDA (Ethylene Diamine) इत्यादि ।
 (क) उभयदंतीय संलग्नी (Ambidentate Ligand)- वैसे संलग्नी जिनमें दो प्रकार के दाता परमाणु उपस्थित होते हैं, तथा केन्द्रीय धातु आयन किसी भी परमाणु से आबंध हो सकता है तो संलग्नी को उभयदंतीय संलग्नी कहा जाता है। जैसे- NO
(क) उभयदंतीय संलग्नी (Ambidentate Ligand)- वैसे संलग्नी जिनमें दो प्रकार के दाता परमाणु उपस्थित होते हैं, तथा केन्द्रीय धातु आयन किसी भी परमाणु से आबंध हो सकता है तो संलग्नी को उभयदंतीय संलग्नी कहा जाता है। जैसे- NO![]() में ‘N’ एवं ‘O’ दो प्रकार के दाता परमाणु उपस्थित हैं। इनमें से किसके साथ भी, आबंध बन सकता है, इसलिए इसे उभयदंतीय संलग्नी कहा जाता है।
में ‘N’ एवं ‘O’ दो प्रकार के दाता परमाणु उपस्थित हैं। इनमें से किसके साथ भी, आबंध बन सकता है, इसलिए इसे उभयदंतीय संलग्नी कहा जाता है।
प्रश्न 17. धात्विक कार्बोनिल से आप क्या समझते हैं ? दो उदाहरण दें। इनका वर्गीकरण करें। प्रत्येक धात्विक कार्बोनिल के दो उदाहरण दें।
उत्तर⇒ वह कार्बधात्विक जिसमें एक या एक से अधिक डी-ब्लॉक के धातु जो कार्बोनिल समूह के साथ बंधन बनाते हैं। उप-सहसंयोजक बंधन के द्वारा धात्विक कार्बोनिल कहलाता है।
e.g.-Ni(CO)4, Fe3 (CO12) और MnCO(CO)4
इनके प्रकार नीचे दिए गए हैं
(a) मोनो न्यूक्लियर धात्विक कार्बोनिल जिनमें एक धात्विक परमाणु प्रति अणु होते हैं।
e.g.-Cr(CO)6Ni(CO)4
(b) पॉलीन्यूक्लियर कार्बोनिल-इसमें एक से अधिक धात्विक परमाणु प्रति अणु होते हैं।
e.g.-Fe3(CO12, MnCO(CO)9
(c) होमोन्यूक्लियर, e.g.-Fe(CO)12
हेट्रोन्यूक्लियर, e.g.-MnCO(CO)9।
प्रश्न 18. क्रिस्टल क्षेत्र विपाटन ऊर्जा क्या है ? उपसहसंयोजन सत्ता में d कक्षकों का वास्तविक विन्यास के Δ० मान के आधार पर कैसे निर्धारित किया जाता है ?
उत्तर⇒ किसी धातु परमाणु या आयन में पाँच d-उपकक्षकों का विपाटन होता है जब लिगेन्ड धातु परमाणु या आयन की ओर लिगेन्ड जाता है। यह सिद्धांत क्रिस्टल विपाटन क्षेत्र सिद्धांत के रूप में जाना जाता है। eg और t2g कक्षकों में ऊर्जा अन्तर क्रिस्टल विपाटन ऊर्जा कहलाती है। यदि Δ० मान उच्च होता है तब कम ध्रुवण का यौगिक बनाता है। जिसमें d2sp3 संकरण होता है जहाँ आन्तरिक संकरण यौगिक बनता है। यदि Δ० का मान कम होता है जब दो d-उपकक्षक मिलकर sp3d2 संकरण यौगिक बनाते हैं जो बाह्य कक्षक यौगिक कहलाता है।
प्रश्न 19. [Ni(H2O)6]2+ का विलयन हरा है परन्तु [Ni(CN)4]2- का विलयन रंगहीन है। समझाइए।
उत्तर⇒ [Ni(H2O)6]2- में Ni+2 आयन हरा रंग उत्पन्न करता है क्योंकि इसमें दो अयुग्मित इलेक्ट्रॉन 3d उपकक्षक में उपस्थित रहते हैं, d – d संक्रमण से यौगिक हरे रंग का होता है। दूसरी ओर [Ni(CN)4]2- आयन में कोई इलेक्ट्रॉन अयुग्मित नहीं है। अतः यह रंगहीन है।
प्रश्न 20. [Fe(CN)6]4- तथा [Fe(H2O)2+ के तनु विलयनों के रंग भिन्न होते हैं। क्यों ?
उत्तर⇒ [Fe(CN)6]4- आयन में d2sp3 संकरण के कारण इलेक्ट्रॉन अयुग्मित नहीं है। 3d उपकक्षक में सभी इलेक्ट्रॉन युग्मित हैं। जबकि [Fe(H2O)6]2+ आयन में चार इलेक्ट्रॉन अयुग्मित हैं जो sp3d2 संकरण उत्पन्न करते हैं। यौगिक में d – d संकरण से भिन्न-भिन्न रंग उत्पन्न होते हैं।
प्रश्न 21. ऐसे दो यौगिकों के नाम लिखो जो दवाइयों में उपयोग होते हैं ?
उत्तर⇒ (i) EDTA का उपयोग सीसा के प्रभाव को कम करने के लिए
(ii) समपक्ष-प्लेटिन [PtCl2(NH3)2] का उपयोग कैंसर के उपचार में होता है।
प्रश्न 22. [NiCI4]2- आयन के ज्यामिति व चुम्बकीय गुण लिखो ?
उत्तर⇒ चतुष्फलक, अनुचुंबकीय।
प्रश्न 23. गोल्ड नम्बर (Gold Number) क्या है ?
उत्तर⇒ गोल्ड नम्बर किसी संरक्षी कोलॉइड की मिलीग्राम में वह मात्रा है जो 10 मिली प्रामाणिक गोल्ड सॉल को 10% नमक के घोल के 1 मिली शीघ्रता से मिलाने पर संकेन्द्रित होने से संरक्षित होने योग्य हो जाता है।
प्रश्न 24. संलग्नी (Ligand) क्या है ?
उत्तर⇒ उप–सहसंयोजक यौगिक में केन्द्रीय परमाणु/आयन से संलग्न अन्य परमाणु या समूह को संलग्नी कहा जाता है जैसे-K4[Fe(CN)6] में CN- संलग्नी है।
प्रश्न 25. उप-सहसंयोजक संख्या (Co-ordination Number) क्या है ?
उत्तर⇒ केन्द्रीय परमाणु आयन एवं संलग्नियों के बीच बने सिग्मा (σ) आबंधों की संख्या, उप-सहसंयोजक यौगिक के केन्द्रीय परमाणु आयन की उप-सहसंयोजन संख्या कहलाती है।
प्रश्न 26. किलेटन (Chelation) क्या है ?
उत्तर⇒ वैसी संलग्नी जिनमें दो या दो से अधिक दाता परमाणु होते हैं, किलेटन कहलाता है। जैसे-EDTA CO![]() इत्यादि ।
इत्यादि ।
प्रश्न 27. समावयता क्या है ?
उत्तर⇒ वैसे यौगिक जिनके अणुसूत्र समान परन्तु संरचना सूत्र अलग-अलग होते हैं, समावयवी कहलाते हैं तथा इस घटना को समावयवता कहा जाता है।
प्रश्न 28. त्रिविम समावयव से आप क्या समझते हैं ?
उत्तर⇒ त्रिविम समावयव के अणु होते हैं जिनके अणुओं में समान परमाणु बंध होते हैं, परन्तु परमाणुओं अथवा समूहों की त्रिविम में भिन्न स्थिति होती है।
class 12th chemistry Subjective question 2022
| S.N | CHEMISTRY ( रसायन विज्ञान ) SUBJECTIVE |
| 1 | ठोस अवस्था |
| 2 | विलयन |
| 3 | वैधुत रसायन |
| 4 | रसायन बलगतिकी |
| 5 | पृष्ठ रसायन |
| 6 | तत्वों के निष्कर्षण के सामान्य सिद्धांत |
| 7 | p-ब्लॉक के तत्व |
| 8 | d एवं -ब्लॉक के तत्व |
| 9 | उप-सहसंयोजक यौगिक |
| 10 | हैलोएलकेन्स तथा हैलोऐरिन्स |
| 11 | ऐल्कोहॉल, फीनॉल एवं ईथर |
| 12 | ऐल्डिहाइड, कीटोन एवं कार्बोक्सिलिक अम्ल |
| 13 | ऐमीन |
| 14 | बहुलक |
| 15 | जैव अणु |
| 16 | दैनिक जीवन में रसायनऔर विविध |

