प्रश्न 1. विलयन को परिभाषित कीजिए। कितने प्रकार के विभिन्न विलयन संभव है ? प्रत्येक प्रकार के विलयन के संबंध में एक
उदाहरण देकर संक्षेप में लिखिए।
उत्तर⇒ विलयन- विलयन दो या दो से अधिक अवयवों का समांगी मिश्रण होता है। समांगी मिश्रण अर्थात् मिश्रण में सभी जगह इसका संघटन व गुण समान है। विलयन नौ प्रकार के होते हैं-
विलयनों के प्रकार
| विलयनो के प्रकार | विलेय | विलायक सामान्य उदाहरणा |
| गैसीय विलयन | गैस | गैस ऑक्सीजन व नाइट्रोजन गैस का मिश्रण |
| द्रव | गैस क्लोरोफॉर्म को नाइट्रोजन गैस में मिश्रित किया जाए | |
| ठोस | गैस कपूर का नाइट्रोजन गैस में विलयन | |
| गैस | द्रव जल में घुली हुई ऑक्सीजन | |
| द्रव विलयन | द्रव | द्रव जल में घुली हुई एथेनॉल |
| ठोस | द्रव जल में घुला हुआ ग्लूकोज | |
| गैस | ठोस हाइड्रोजन का पैलेडियम में विलयन | |
| द्रव | ठोस पारे का सोडियम के साथ अमलगम | |
| ठोस विलयन | ठोस | ठोस ताँबे का सोने में विलयन |
प्रश्न 2. मान लीजिए कि दो पदार्थों को मिलाकर एक ठोस विलयन बनाया गया जिनमें एक के कण बहुत बड़े एवं दूसरे के बहुत छोटे हैं, यह ठोस विलयन किस प्रकार के होने की संभावना है ?
उत्तर⇒ ठोस पदार्थ जिसके अवयवों का आकार छोटा होता है ऐसे अवयव जालक स्थान पर जगह घेरते हैं तथा वे अवयव जिनका आकार बड़ा होता है वे जालक विलयन बनाते हैं जैसे-टंगस्टन (w) कार्बन (c) संयोग कर जालक ठोस wc बनाते हैं। छोटे विलय अवयव अंतराकाशी रिक्ति पर जगह बनाते हैं। wc टंगस्टन, कार्बन कठोर ठोस बनाते हैं। जो ठोस विलयन के उदाहरण हैं।
प्रश्न 3. वर्णन करें कि अनादर्श विलयन राउल्ट नियम का पालन नहीं करता।
उत्तर⇒ जब कोई विलयन सभी सान्द्रताओं पर राउल्ट के नियम का पालन नहीं करता तो यह अनादर्श विलयन कहलाता है। इस प्रकार के विलयनों का वाष्प दाब राउल्ट के नियम द्वारा प्रयुक्त किए गए वाष्प दाब से या तो अधिक होता है या कम।
प्रश्न 4. निम्न शर्तों पर वाण्ट हॉफ गुणक
(i) एक के बराबर होता है (ii) एक से बड़ा होता है (iii) एक से छोटा होता है।
उत्तर⇒ (i) i = 1 यदि विलेय, विलयन में न तो वियोजित हो तथा न ही संयोजित हो।
(ii) i > 1 यदि विलेय, विलयन में वियोजित हो जाए।
(iii) i < 1 यदि विलेय, विलयन में संयोजित हो जाए।
प्रश्न 5. क्या कारण है कि स्थिर क्वाथी विलयन संगठन परिवर्तन बिना ही अलग किए जा सकते हैं ?
उत्तर⇒ द्रव मिश्रण में उपस्थित दोनों अवयव वाष्पित होकर समान संख्या में मोल-अंश दर्शाते हैं जब इन्हें गरम किया जाता है।
प्रश्न 6. कुछ पदार्थों की घुलनशीलता ऊष्माक्षेपी है तथा कुछ के लिए यह ऊष्माशोषी क्यों ?
उत्तर⇒ यदि विलयन में विलेय-विलायक में मध्य आकर्षण बल अधिक है तब ऊष्मा उत्पन्न होती है और घुलनशीलता प्रक्रम ऊष्माशोषी है। यदि विलेय–विलायक के मध्य आकर्षण कम है तब यह प्रक्रम ऊष्माक्षेपी है।
प्रश्न 7. प्रभावी आसवन विधि जल को ऐथाइल एल्कोहल से अलग नहीं किया जा सकता क्यों ?
उत्तर⇒ 95.4% ऐथाइल एल्कोहल तथा 4.6% जल स्थिर क्वाथी विलयन बनाते हैं 351.1 K ताप पर। अतः दोनों को आशक्त किया जा सकता।
प्रश्न 8. किसी ताप पर बेंजीन और टॉलुईन मिश्रण का वाष्प दाब को mm में दर्शाया गया है जो निम्न है-
p = 100x + 60 जहाँ x बेंजीन के लिए मोल अंश है। इस ताप पर शुद्ध अवयव के लिए वाष्प दाब ज्ञात करें।
उत्तर⇒ जब x = 0 तब p = 60 mm
जब x = 1 तब बेंजीन के लिए p = 100 × 1 + 60 = 160 mm
प्रश्न 9. विलयन की मोलर सान्द्रता पर तापमान पर क्या प्रभाव है ?
उत्तर⇒ तापमान बढ़ने से मोलरता घटती है क्योंकि तापमान के बढ़ने से विलयन का आयतन बढ़ता है लेकिन मोल संख्या रहती है।
प्रश्न 10. निम्न जलीय विलयन में किसकी सान्द्रता अधिक है ? (i) 1 मोलर विलयन (ii) 1 मोलल विलयन।
उत्तर⇒ 1 मोलल विलयन से 1 मोलर विलयन की सान्द्रता अधिक है। ऐसा इसलिए है क्योंकि 1 मोलल 1000 ग्राम विलायक में 1 मोल संख्या है जबकि 1 मोलर 1000 सेमी3 आयतन विलयन में 1 मोल संख्या है। इनका आयतन 1000 सेमी3 विलायक से कम है।
प्रश्न 11. अणुसंख्य गुणधर्म क्या है ? उदाहरण दें।
उत्तर⇒ विलयन के वे गुण जो वाष्प दाब की अवनमन से संबंधित हैं। ये सभी गुण विलयन में उपस्थित कुल कणों की संख्या तथा विलेय कणों की संख्या के अनुपात पर निर्भर करते हैं न कि विलेय कणों की प्रकृति पर। ऐसे गुणों को अणुसंख्य गुणधर्म कहते हैं। अणुसंख्य गुणधर्म संख्या में चार हैं
1. वाष्प दाब का आपेक्षिक अवनमन,
2. क्वथनांक का उन्नयन,
3. हिमांक का अवनमन एवं
4. परासरण दाब।
प्रश्न 12. क्या होता है जब रक्त कोशिकाओं को जल में रखा जाता है ?
उत्तर⇒ परासरण के कारण जल अणु रक्त कोशिका के अन्दर चले जाते हैं। परिणामस्वरूप रक्त कोशिका का आकार बढ़ जाता है और फट जाती है।
प्रश्न 13. परिसारक दाब को परिभाषित करें। क्यों परिसारक दाब अपसामान्य हो जाता है ?
उत्तर⇒ परिसारक दाब-घोल पर आरोपित वह अतिरिक्त दाब जो घोलक का घोल में प्रवेश को रोक देता है जब घोल एवं घोलक का अर्द्धपारगम्य झिल्ली में अलग किया जाता है, परासरण दाब कहलाता है।
π = CRT =![]() RT
RT
जहाँ C = मोलरता में सांद्रण
V = विलयन का आयतन,
R = एक स्थिरांक,
T = परम ताप
परासरणी दाब विलयन में उपस्थित विलेय कणों की संख्या पर निर्भर करते हैं। चाहे यह कण अणु, परमाणु अथवा आयन क्यों न लें। इनके प्रायोगिक एवं सैद्धांतिक मान में भिन्नता आ जाती है। इसी कारण से परासरणी दाब अपसामान्य होता है।
प्रश्न 14. ताप बढ़ाने पर गैसों की द्रवों में विलेयता में, हमेशा कमी आने की प्रवृत्ति क्यों होती है ?
उत्तर⇒ विलयन की घुलनशीलता ताप के बढ़ने पर घटती है क्योंकि गैस बाहर आ जाती है।
गैसों की घुलनशीलता के लिए संन्थेल्पी मान ऊष्मा अवशोषित प्रक्रम है।
गैस + विलायक![]() विलयन + ऊष्मा
विलयन + ऊष्मा
ली चैटिलियर सिद्धांत के अनुसार ताप बढ़ने पर प्रक्रम विपरीत दिशा में बढ़ता है अर्थात् गैसों की घुलनशीलता घटती है। हालाँकि कुछ अपवाद भी हैं।
प्रश्न 15. हेनरी के नियम का नियतांक (KH) के महत्व क्या है ?
उत्तर⇒ किसी गैस के हेनरी के नियम का नियतांक (KH) का मान जितना ही अधिक होता है, उसकी विलेयता उतना ही कम होती है। जैसे ही ताप बढ़ता है गैस की विलेयता घटने लगती है।
प्रश्न 16. एक घोल के लिए राउल्ट्स के नियम (Raoult’s law) को लिखें।
उत्तर⇒ राउल्ट्स के नियम के अनुसार किसी दिये गये ताप पर किसी अवाष्पशील विलेय वाले विलयन का वाष्पदाब शुद्ध विलायक के वाष्पदाब और उसके मोल-अंश के गुणनफल के बराबर होती है।
प्रश्न 17. पतले विलयन का कोलीगेटिव गुण क्या है ? विभिन्न प्रकार के कोलीगेटिव गुणों की चर्चा करें।
उत्तर⇒ पतले विलयन का वह गुण, जिसमें अउड़नशील विलेय रहता है, जो केवल विलेय के कर्णों की संख्या पर निर्भर करता है, जितना अपने गुणों से पृथक वाले विलयन में उपस्थित होता है। इसे ही पतले विलयन का कोलीगेटिव गुण कहते हैं।
कोलीगेटिव गुणों के प्रकार-
(i) विलयन का वायुदाब अवदमन ।
(ii) विलयन के क्वथनांक का उन्नयन।
(iii) विलयन के हिमांक का अवनमन ।
(iv) विलयन का परिसारक दाब।
प्रश्न 18. ठण्डे स्थानों पर कार के रेडिऐटर में ऐथिलीन ग्लाइकॉल डालने की सलाह दी जाती है। क्यों ?
उत्तर⇒ क्योंकि इससे पानी के हिमांक का अवनमन हो जाता है। अतः यह शून्य O°C ताप पर नही जमता है।
प्रश्न 19. मोल प्रभाज से आप क्या समझते हैं ?
उत्तर⇒ मोल प्रभाज, विलयन के एक अवयव के मोल एवं कुल मोलों के सरल अनुपात को कहा जाता है।

प्रश्न 36. सामान्यता से आप क्या समझते हैं ?
उत्तर⇒ एक लीटर विलयन में विलेय के घुले हुए ग्राम तुल्यांकी भार की संख्या को विलयन की सामान्यता कहा जाता है।
सामान्यता = ![]()
प्रश्न 20. रॉउल्ट के नियम को लिखें।
उत्तर⇒ किसी विलयन में उसके अवयवों का आंशिक वाष्प दाब उसके मोल प्रभाज का सीधा समानुपाती होता है।
या, विलयन के अवयवों का आंशिक दाब उसके मोल प्रभाज एवं वाष्प दाब के बराबर होता है।
![]()
प्रश्न 21. अर्द्ध-पारगम्य झिल्ली क्या है ?
उत्तर⇒ अर्द्ध-पारगम्य झिल्ली वैसी झिल्ली को कहा जाता है, जिनसे होकर सिर्फ विलायक के अणु ही पार कर सकते हों, विलेय के नहीं।
प्रश्न 22. परिसारक दाब क्या है ?
उत्तर⇒ याद कसा घोल को घोलक के एक अर्द्ध-पारगम्य झिल्ली द्वारा अलग रखा जाए तो घोल को घोलक में जाने से रोकने के लिए लगाया गया दाब, उस घोलक का परिसारक दाब कहलाता है।
प्रश्न 23. आइसोटॉनिक घोल क्या है ?
उत्तर⇒ वैसा घोल जिसका परिसारक दाब समान हो, आइसोटॉनिक घोल कहलाता है।
प्रश्न 24. हाइपरटॉनिक घोल क्या है ?
उत्तर⇒ अगर किसी घोल का परिसारक दाब दूसरे घोल की अपेक्षा अधिक हो, तो ऐसे घोल को हाइपरटॉनिक घोल कहते हैं।
प्रश्न 25. समपरिसारी घोल का एक उदाहरण दें।
उत्तर⇒ 5% यूरिया एवं 15% ग्लूकोज का जलीय घोल ।
प्रश्न 26. ऐल्कोहल एवं जल के एक विलयन में आण्विक अन्योन्यक्रिया की क्या भूमिका है ?
उत्तर⇒ इथाइल एल्कोहल और जल का मिश्रण अनादर्श विलयन बनाते हैं। यह विलयन ऋणात्मक विलयन दर्शाता है, राउल्ट के नियम से ऋणात्मक विचलन की स्थिति में विलेय-विलेय अणुओं व विलायक-विलायक अणुओं के बीच अंतराण्विक आकर्षण बल विलेय-विलायक अणुओं के आकर्षण बल की तुलना में कम होता है। परिणामस्वरूप वाष्प दाब कम हो जाता है। इथाइल एल्कोहल के अणु हाइड्रोजन बंध से बंधे होते हैं।
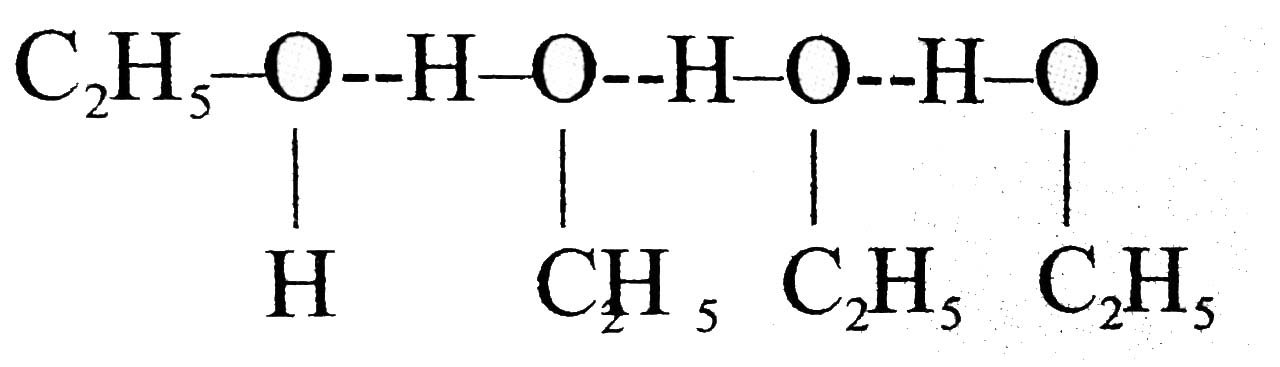
जब इथाइल एल्कोहल में जल मिलाया जाता है तब जल व इथाइल एल्कोहल के मध्य नए हाइड्रोजन आबंध बनते हैं ऐसे विलयनों का ऐन्थेल्पी मान बढ़ता है अतः यह प्रक्रम ऊष्माशोषक है तथा आयतन का मान बढ़ता है अतः ΔH > O (मिश्रण) और ΔV > O (मिश्रण) गरम करने पर विलयन की घुलनशीलता बढ़ती है।
प्रश्न 27. उन कारकों का उल्लेख करें जिन पर ठोस द्वारा गैसों का अधिशोषण निर्भर करता है।
उत्तर⇒ ठोस द्वारा गैसों का अधिशोषण निम्न बातों पर निर्भर करता है
(i) गैस की प्रकृति
(ii) ठोस की प्रकृति
(iii) ठोस का पृष्ठीय क्षेत्रफल
(iv) गैस का दाब
(v) तापमान
(vi) अधिशोषण की सक्रियता।
प्रश्न 28. क्या होता है जब कोलॉइडी विलयन का अपोहन किया जाता है ?
उत्तर⇒ कोलॉइडी विलयन का स्थायी तत्व उसमें उपस्थित वैद्युत अपघट्य पर निर्भर करता है। अपोहन से इन्हें हटा लिया जाता है। परिणामस्वरूप कोलॉइडी विलयन अस्थायी हो जाता है और स्कंदन में परिवर्तित हो जाता है।
प्रश्न 29. द्रवरागी विलयन, द्रवविरागी विलयन से अधिक स्थायी क्यों होते हैं ?
उत्तर⇒ द्रवरागी विलयन उच्च जलयोजन दर्शाते हैं और इनके विलायक विलायक आकर्षण अधिक होता है। जबकि द्रवविरागी विलयन में परिक्षेपण माध्यम से प्रतिकर्षण दर्शाता है अतः कम स्थायी है।
प्रश्न 30. जल में तेल और तेल में जल प्रकार के इमल्शन में क्यों अन्तर है ?
उत्तर⇒ इमल्शन में थोड़ी-सी मात्रा तेल में घुलनशील रंजक डाला जाता है। यदि इमल्शन तेल में जल है तब वह गहरा रंग उत्पन्न करता है अन्यथा विलयन का रंग ऐसा ही रहता है।
प्रश्न 31. आर्सेनियस सल्फाइड के 100 ml विलयन को स्कंदित करने के लिए 1 M NaCl मिलाया जाता है। NaCl का स्कंदन मान क्या है ?
उत्तर⇒ 1 M NaCl के 5 ml विलयन में ![]() × 5 = 5 मिली मोल
× 5 = 5 मिली मोल
अतः As2S3 के 100 ml विलयन की आवश्यकता है = 5 मिली मोल NaCl
∴ 1 लीटर विलयन की आवश्यकता होगी = 50 मिली मोल NaCl
∴ NaCl की स्कंदन मान = 50
प्रश्न 32. 0.25 ग्राम स्टार्च 100 ml स्वर्ण को कोलॉइडी विलयन में स्कंदन को पूर्ण रूप से रोकता है। 10% व 1 मिली Nacl के विलयन को डालने से पहले स्टार्च की स्वर्ण संख्या बताएँ।
उत्तर⇒ 1 ml 10% NaCl = 0.25 gm = 250 mg
अतः स्टार्च की आवश्यकता = 25 mg
∴ परिभाषा अनुसार स्वर्ण संख्या = 25
प्रश्न 33. स्कंदन से आप क्या समझते हैं ?
उत्तर⇒ मिली मोल में वैद्युत अपघट्य का वह न्यूनतम मान जो 1 लीटर कोलॉइडल सॉल का स्कंदन करता है वह मान वैद्युत अपघट्य का स्कंदन मान कहलाता है।
प्रश्न 34. इनमें लिए किस प्रकार के कोलॉइडी सॉल बनते हैं- (i) सल्फर वाष्प को ठण्डे जल से गुजारने पर (ii) अण्डे की जर्दी पानी में मिलाने पर (iii) साबुन विलयन ।
उत्तर⇒ (i) बहुआण्विक (ii) वृहतआण्विक (iii) संकलित।
प्रश्न 35. किसी विलयन की चालकता तनुता के साथ क्यों घटती है ?
उत्तर⇒ किसी विलयन की चालकता सांद्रता कम होने पर घटती है । क्योंकि आयनों की संख्या प्रति cm2 आयतन से कम होती है।
class 12th chemistry Subjective question 2022
| S.N | CHEMISTRY ( रसायन विज्ञान ) SUBJECTIVE |
| 1 | ठोस अवस्था |
| 2 | विलयन |
| 3 | वैधुत रसायन |
| 4 | रसायन बलगतिकी |
| 5 | पृष्ठ रसायन |
| 6 | तत्वों के निष्कर्षण के सामान्य सिद्धांत |
| 7 | p-ब्लॉक के तत्व |
| 8 | d एवं -ब्लॉक के तत्व |
| 9 | उप-सहसंयोजक यौगिक |
| 10 | हैलोएलकेन्स तथा हैलोऐरिन्स |
| 11 | ऐल्कोहॉल, फीनॉल एवं ईथर |
| 12 | ऐल्डिहाइड, कीटोन एवं कार्बोक्सिलिक अम्ल |
| 13 | ऐमीन |
| 14 | बहुलक |
| 15 | जैव अणु |
| 16 | दैनिक जीवन में रसायनऔर विविध |

