प्रश्न 1. किसी वैद्युत अपघट्य के विलयन की चालकता. मोलर चालकता की परिभाषा दीजिए। सांद्रता के साथ इनके पास की विवेचना कीजिए।
उत्तर⇒ चालकत्व या विशिष्ट चालकत्व (k कप्पा) प्रतिरोधकता के व्युत्क्रमानुपाती होते हैं।
यह उस पदार्थ की चालकता है जो लम्बाई में 1 मीटर और पृष्ठीय क्षेत्रफल 1m2 हो।
इसके लिए इकाई सिमेन मी-1 है
1 Scm-1 = 100 Sm-1
1 सिमेन या 1S= 1Ω-1 या 1 मोल
यदि इस विद्युत अपघट्य विलयन को 1cm2 आयतन के बर्तन में तथा इलेक्ट्रोड 1 cm दूरी पर हो, लेते हैं तब चालकत्व विशिष्ट चालकत्व कहलाएगा।
k (कप्पा) के लिए इकाई = Ω-1 Cm-1
मोलर चालकत्व : मोल वैद्युत अपघट्य उत्पन्न आयनों से उत्पन्न चालकत्व मोलर चालकत्व कहलाता है। इसे λ (लेम्डा) द्वारा दर्शाया जाता है। मोलर चालकता व विशिष्ट चालकत्व में संबंध – λm = k/M.
जहाँ M मोलर सांद्रता है यदि M की इकाई मोलरता है अर्थात् मोल/लीटर तब λm होगा।
![]()
मोलर चालकत्व की इकाई Sm2 mol-1
विशिष्ट चालकत्व : विशिष्ट चालकत्व या चालकत्व सांद्रता घट घटती है क्योंकि प्रति Cm3 आयतन में आयन संख्या कम होती हैं मोलर चालकत्व या सांद्रता के साथ इसके माने को दर्शाने के लिए दुर्बल या प्रबल वैद्यत अपघट्य द्वारा उत्पन्न चालकत्व को लेते हैं।
(i) दुर्बल वैद्युत अपघट्य का चालकत्व : λm पर सांद्रता के प्रभाव को प्रति Cm3 आयतन में आयन संख्या से समझा जा सकता है। आयनों की नियोजन डिग्री पर निर्भर करती है। सांद्रता घटने पर वियोजन डिग्री बनती है परिणामस्वरूप मोलर सांद्रता बढ़ती है।
वियोजन डिग्री को निम्न अनुसार मापा जा सकता है।

जहाँ α वियोजन डिग्री, Λmc मोलर चालकत्व तथा C सांद्रता पर
(ii) प्रबल वैद्युत अपघट्य का चालकत्व : प्रबल वैद्युत अपघट्य के लिए सांद्रता घटने पर आयन की संख्या नहीं बढ़ती है क्योंकि प्रबल अपघट्य पर्णरूप से वियोजित हो जाता है हालांकि सांद्र विलयन में आयनों के मध्य प्रबल आकर्षण होता है। इस प्रबल आकर्षण बल के कारण आयन का चालकत्व कम होता है। सांद्रता कम करने पर आयनों के बीच दूरी बढ़ जाती है परिणामस्वरूप चालकत्व बढ़ जाता है। जब सांद्रता निम्नतम रूप में होती है तब आयनों के मध्य आकर्षण बल न के बराबर होता है तब मोलर चालकत्व अनन्त को छूता है। ऐसी स्थिति में λm को λ![]() द्वारा दर्शाते हैं।
द्वारा दर्शाते हैं।

प्रश्न 2. समझाइए कि कैसे लोहे पर जंग लगने का कारण एक वैद्युत रासायनिक सेल बनना माना जाता है ?
उत्तर⇒ वायु तथा जल के संपर्क से लोहे को जंग लगना एक वैद्युत रासायनिक अभिक्रिया है धातु के धरातल पर बहुत-सी सेलों का निर्माण हो जाता है।
.
ऐनोड पर : 2Fe → 2Fe+2 + 4e–
E0 Fe+2।Fe = – 0.4400
इलेक्ट्रॉन खोकर Fe परमाणु Fe+2 आयन में ऑक्सीकृत हो जाता है । उत्पन्न इलेक्ट्रॉन ऑक्सीजन को अपचयित करते हैं जो H+ आयन की उपस्थिति से संभव है।
कैथोड पर : O2 + 4H+ + 4e– → 2H2O(I)
E0H+|020 = – 0.23 Volt
पूर्ण अभिक्रिया : 2Fe + O2 +4H+ + 4e– → 2Fe2 + 2H2O
E0सेल = 1.67 Volt
वायुमण्डलीय ऑक्सीकरण :
2Fe+2 (aq) + 2H2O (1) + ![]() O2(g) → Fe2O3(s) + 4H+ (aq)
O2(g) → Fe2O3(s) + 4H+ (aq)
प्रश्न 3. कोहलारस्क नियम को परिभाषित करें। यह नियम निम्न के लिए कैसे उपयोगी है ?
1. दुर्बल अपघट्य के लिए Λα की गणना में।
2. दुर्बल अपघट्य के लिए वियोजन डिग्री गणना के लिए।
उत्तर⇒ अनन्त सांद्रता पर किसी वैद्युत अपघट्य की मोलर चालकत्व के द्वारा उत्पन्न आयनों की चालकत्व का योग होता है आयनिक चालकत्व को फार्मूला इकाई में उत्पन्न आयनों की संख्या से गुणा करते हैं ।
गणितीय प्रारूप : AxBy यौगिक के लिए Λαm
= xλ0 Λy+ + yλ0BX
जहाँ Aαm अन्नत सांद्रता पर अपघट्य की मोलर चालकत्व है।
तथा λ0Ay और λ0BX धनायन और ऋणायन की मोलर चालकत्व है।
उदाहरण- Λα mNaCl = λα Na++ λαcr
ΛαmBaCl2 = λαBa++ λα cl
ΛαmAl2(SO4) = 2λα Al+3 +3 λα SO2-2
साम्यांक चालकत्व के लिए कोहलारस्क नियम के अनुसार अनन्त सांद्रण पर अपघट्यों की साम्यांक चालकत्व दो संख्याओं का मान है एक जो धनायन पर व दूसरी ऋणायन के मान का योग है।
Λαm = λαc+ λαa
जहाँ λαc और λαa आयनिक चालकत्व है जो अनन्त सांद्रण पर है।
कोहलारस्क नियम की उपयोगिता :
1. दुर्बल अपघट्यों की मोलर चालकत्व की गणना करने के लिए-कोहलारस्क नियम दुर्बल अपघट्यों की मोलर चालकत्व की गणना करने के लिए बहुत उपयोगी है। पहले ही वर्णन किया जा चुका है कि Λαm का मान सीधे रूप से ज्ञात नहीं किया जा सकता इसे कोहलारस्क नियम से ज्ञात किया जा सकता है।
उदाहरण-ऐसीटिक अम्ल के लिए Λαm का मान यदि आयनों की मोलर चालकत्व का ज्ञान है तो ज्ञात किया जा सकता है, आयनों की मोलर चालकत्व का मान प्रबल आयनों Cu, COONa, HCl और NaCl की सहायता से ज्ञात किया जा सकता है।
∴ Λαm(CH3COOH) = λ0(CH3COO–) + λ0H+
अब λαNa+ और λαcr के मानों को जोड़ने पर घटाने पर
ΛαCH2COOH =λα CH2COO– + λα H- + λαNa- + λα cr+ – λα cl
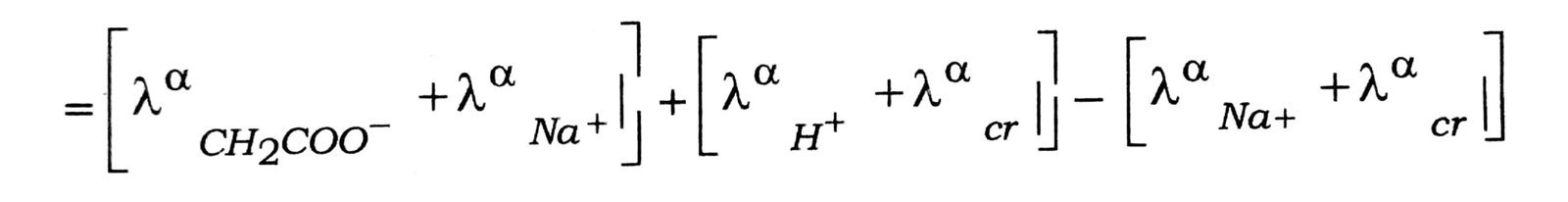
= Λαm (CH2COONa) + Λαm (HCl) – Λαm (NaCl) इसी प्रकार
= Λαm (NH3OH) = Λαm (NH4Cl) + Λαm (NaOH) – Λαm (NaCl)
2. दुर्बल अपघट्यों के लिए वियोजन डिग्री ज्ञात करने के लिए-किसी अपघट्य के लिए मोलर चालकत्व उसकी वियोजन डिग्री पर निर्भर करती है वियोजन डिग्री का मान उच्च है तब उच्च मोलर चालकत्व होगा सांद्रता कम करने पर वियोजन डिग्री का मान बढ़ता है। अनन्त साब पर उच्चतम वियोजन डिग्री होती है।
अतः यदि Λαm किसी सांद्रता पर विलयन की मोलर चालकत्व
Λαm = अनन्त सांद्रता पर मोलर चालकत्व
![]()
प्रश्न 4. वैधुत रासायनिक सेल I है ? यह किस सिद्धान्त पर कार्य करती है ? डेनियल सेल की कार्य प्रणाली का वर्णन करें। लवण सेतू का क्या कार्य है ? इस प्रकार की सेल के उदाहरण दें।
उत्तर⇒ एक वोल्टीय/गैल्वेनिक/वैद्युत रसायन सेल व यंत्र होता है जो रासायनिक ऊर्जा को वैद्युत ऊर्जा में बदलता है।
गिब्ज ऊर्जा का घटता मान विद्युत ऊर्जा का मापन करता है।
-ΔG0 =Wवैधुत = nFE0
E0 = e.m.f. सेल
n = इलेक्ट्रॉन संख्या
F = पैफराडे = 96500 कूलॉम
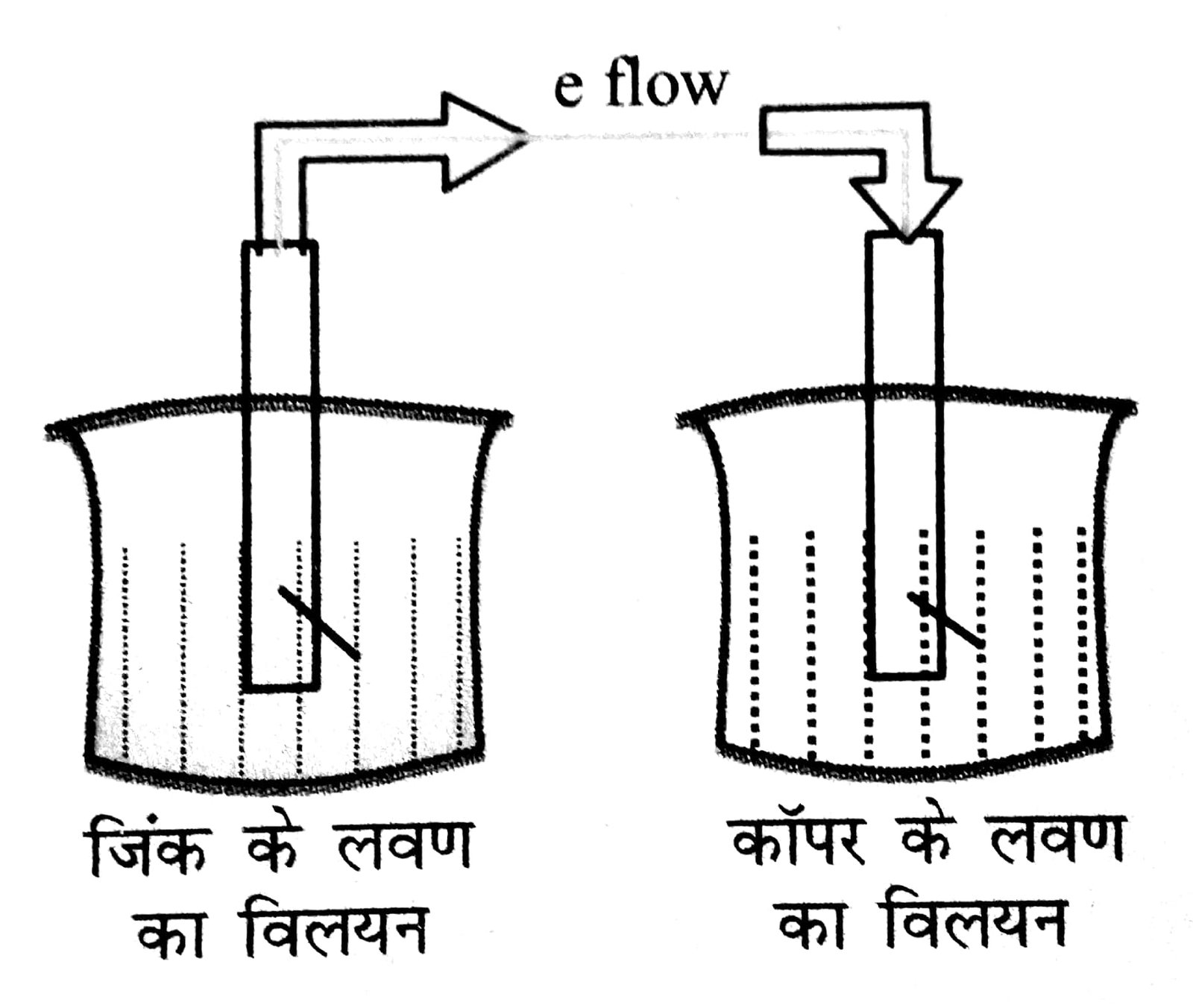 इस प्रकार की एक सेल का नाम डेनियल सेल है
इस प्रकार की एक सेल का नाम डेनियल सेल है
डेनियल सेल में जिंक पट्टी को ZnSO4 विलयन में डुबोया जाता है और कॉपर पट्टी को कॉपर सल्फेट विलयन में। दोनों बीकरों को लवण सेत से जोड़ा जाता है। बाह्य परिपथ में एक वोल्टमापी जोड़ा जाता है।
वोल्टमापी में हलचल दर्शाता है कि दोनों इलैक्ट्रोड के बीच विद्युत विभव उत्पन्न हुआ। धारा बाह्य परिपथ में कैथोड से ऐनोड की ओर तथा इलेक्ट्रॉन ऐनोड से कैथोड की ओर गमन करते हैं।
सेल की कार्य विधि :
(i) जिंक परमाणु ऑक्सीकृत होकर जिंक आयन बनाते हैं।
Zn(s) → Zn+2 + 2e–
(ii) उत्पन्न इलेक्ट्रॉन कॉपर तार के माध्यम से कॉपर पट्टी की ओर गमन करते हैं।
(iii) कॉपर आयन कॉपर प्लेट की ओर गमन कर इलेक्ट्रॉन ग्रहण करते हैं।
Cu+2 → 2e– Cu(s)
इलैक्ट्रोड जिस पर ऑक्सीकरण होता है ऐनोड कहलाता है तथा जिस इलैक्टोड पर अपचयन होता है कैथोड कहलाता है। सेल में ऑक्सीकरण से ऐनोड इलेक्ट्रॉन स्रोत बनता है। तथा अपचयन के कारण कैथोड इलेक्ट्रॉन ग्रहण करता है। अतः विद्युत रसायन सेल में
कैथोड धन आवेशित टर्मिनल तथा ऐनोड ऋणावेशित टर्मिनल के रूप में कार्य करते हैं।
लवण सेतू कार्य : वैद्युत रसायन सेल में लवण सेतू निम्न दो काई करता है-
1. परिपथ पूर्ण कर धारा प्रवाह में सहायक है।
2. वैद्युत अपघट्य के आयन लवण सेतु के माध्यम से ऐनोड की ओर गमन करता है अतः लवण सेतू आयनों को एक जगह इकट्ठा होने से रोकता है तथा धारा प्रवाह को बनाए रखता है। कभी-कभी वैद्युत रसायन सेल में लवण सेतू के स्थान पर छिद्रयुक्त माध्यम लगाया जाता है जो इलेक्ट्रॉन प्रवाह तथा आयन के स्थानान्तरण को बनाए रखते हैं।
गैल्वेनिक सेल का निरूपण-गैल्वेनिक सेल दो अर्ध अभिक्रियाओं का योग है। एक ऑक्सीकरण अर्ध सेल तथा दूसरी अपचयन अर्ध सेल के नाम से जाना जाता है। यदि तत्त्व को M से तथा धनात्मक Mn+ से निरूपित किया जाए तब
अर्ध ऑक्सीकरण सेल निरूपण M | Mn+(c) अर्ध अपचयन सेल निरूपण Mn+ (c) | M.
दोनों निरूपण में C का अर्थ सांद्रता है तथा कैथोड को दाईं तथा ऐनोड को बाईं ओर रखा जाता है। दोहरी रेखाओं के नीचे दर्शाया जाता है। कुछ प्रभाव वैद्युत रसायन सेल को सारणी के रूप में नीचे दर्शाया गया है –
 प्रश्न 5. मोलर चालकता पर तनुता का क्या प्रभाव पड़ता है ?
प्रश्न 5. मोलर चालकता पर तनुता का क्या प्रभाव पड़ता है ?
उत्तर⇒ दुर्बल विद्युत अपघट्य की आण्विक चालकता सांद्रण घटने और तनुता बढ़ने से तेजी से बढ़ता है क्योंकि दोनों आयनों की संख्या और आयनिक मोबाइलिटी तनुता से बढ़ता है।
सबल विद्युत अपघट्य की आण्विक चालकता तनुता बढ़ने से बहुत धीरे-धीरे बढ़ती है क्योंकि आयनों की संख्या में बहुत परिवर्तन नहीं होता है, लेकिन आयनिक मोबाइलिटी बढ़ता है।
 प्रश्न 6. फैराडे के विद्युत विच्छेदन के प्रथम नियम को लिखें। विद्युत रासायनिक तुल्यांक की परिभाषा दीजिये।
प्रश्न 6. फैराडे के विद्युत विच्छेदन के प्रथम नियम को लिखें। विद्युत रासायनिक तुल्यांक की परिभाषा दीजिये।
उत्तर⇒ फैराडे का प्रथम नियम-फैराडे के विद्युत विच्छेदन के प्रथम नियमानुसार, विद्युत विच्छेदन में इलेक्ट्रोड पर मुक्त पदार्थ की मात्रा प्रवाहित धारा की मात्रा के सीधे समानुपाती होती है।
यदि Q कुलम्ब आवेश से W ग्राम पदार्थ इलेक्ट्रोड पर जमा होता है
W ∝ W
या W = ZQ चूँकि Q =It
W = Z It
जहाँ Z = विद्युत रासायनिक तुल्यांक, I = विद्युत और t = समय
यदि Q = 1C, I = 1amp और t = 1 सेकेण्ड
तो W = Z
विद्युत विच्छेदन में 1 कुलम्ब आवेश प्रवाहित करने से इलेक्ट्रोड पर मुक्त पदार्थ के द्रव्यमान को उस पदार्थ का विद्युत रासायनिक तुल्यांक कहते हैं।
प्रश्न 7. निम्नलिखित विधियों द्वारा धाराओं के शोधन के सिद्धान्तों की रूपरेखा दीजिए
(i) मंडल परिष्करण (ii) वैद्युत अपघटन परिष्करण (iii) वाष्प प्रावस्था परिष्करण।
उत्तर⇒ (i) मंडल परिष्करण-हाँ, 1773 K ताप से नीचे Mg, SiO2 का अपचयन कर सकता है। Si, MgO का अपचयन 1773 K ताप से ऊपर अपचयन करता है।
(ii) वैद्युत अपघटन परिष्करण-इस विधि में अशुद्ध धातु की ऐनोड बनाते हैं। उसी धातु की शुद्ध धातु इन्हें को कैथोड की तरह प्रयुक्त करते है। उन्हें एक उपयुक्त वैद्युत अपघटनी विश्लेषित में रखते हैं जिसमें उसी धातु का लवण घुला रहता है। अधिक क्षारकीय धातु विलयन में रहती है तथा कम क्षारकीय धातुएँ एनोड पंक में चली जाती है।
एनोड- M → Mn+ + ne–
कैथोड- Mn+ + ne– → M
कॉपर का शोधन वैद्युत अपघटनी विधि के द्वारा किया जाता है। अशुद्ध ऐनोड के रूप में तथा शुद्ध कॉपर पत्री कैथोड के रूप में लेते हैं। कॉपर सल्फेट का अम्लीय विलयन वैद्युत अपघटन होता है तथा वैद्युत अपघट्य के वास्तविक परिणामस्वरूप शुद्ध कॉपर ऐनोड से कैथोड की तरफ स्थानांतरित हो जाता है।
.एनोड- Cu → Cu+2 | 2e–
कैथोड- Cu+2 + → 2e– Cu
फफोलेदार कॉपर से अशुद्धियाँ ऐनोड पंक के रूप में जमा होती है।
(iii) वाष्प प्रावस्था परिष्करण-इस विधि में धातु को वाष्पशील यौगिक में परिवर्तित किया जाता है। इसके लिए दो आवश्यकताएँ होती हैं-
(क) उपलब्ध अभिकर्मक के साथ धातु वाष्पशील यौगिक बनाती हो।
(ख) वाष्पशील पदार्थ आसानी से विघटित हो सकता है।
निकेल शोधन का मॉन्ड प्रक्रम इस प्रक्रम में निकेल को कार्बन मोनोऑक्साइड के प्रवाह में गरम करके प्राप्त करते हैं।
Ni + 4CO ![]() [Ni(CO)4]
[Ni(CO)4]
इस कार्बोनिल को और अधिक ताप पर गरम करते हैं जिससे यह विघटित होकर शुद्ध धातु देता है।
Ni(CO)4 ![]() Ni + 4CO
Ni + 4CO
जिर्कोनियम या टाइटेनियम शोधन के लिए वॉन आरकैल विधि
यह विधि Zr तथा Ti जैसी धातुओं में शुद्धिकरण के लिए उपयोगी है। परिष्कत धातु को निर्वाति पात्र में आयोडीन के साथ गरम करते हैं।
Zr + 2l2 → Zrl4
धातू आयोडाइड को विद्युत धारा में 1800 K ताप पर गरम करते हैं।
Zrl4 → Zr + 2I2
प्रश्न 8 लेड स्टोरेज बैटरी के रिचार्जिंग विधि की व्याख्या करें।
उत्तर⇒ लेड स्टोरेज बैटरी के रिचार्जिंग इस प्रकार की जाती है-
PbSO4(s) + 2e → Pb(s) + SO![]() (aq) अवकरण
(aq) अवकरण
PbSO4 (s) + 2H2O (l) → PbO2 (s) + SO![]() (aq) + 4H+ (aq) +
(aq) + 4H+ (aq) +
. 2e ऑक्सीकरण
_____________________________________
2PbSO4 (s) + 2H2O (l) → Pb (s) + PbO2 (s) + 4H+ (aq) +
. 2SO![]() (aq)
(aq)

