
6. तत्त्वों के निष्कर्षण के सामान्य सिद्धांत LONG ANSWER TYPE QUESTIONS
प्रश्न 1. हेमाटाइट अयस्क से लोहे का निष्कर्षण धमन भट्टी (Blast furmace) से कैसे किया जाता है? धातुकर्म की व्याख्या करते हुए अभिक्रिया भी लिखें।
उत्तर⇒ लोहे का अयस्क हेमाटाइट (Fe2O3) है जिसमें मुख्य रूप से बालु सिलिका (SiO2) अशुद्धि होता है। हेमाटाइट (Fe2O3) को कोक (C) तथा चुना पत्थर (CaCO3) के साथ वात्या भट्टी (Blast furnace) में डाला जाता है।
आयरन के ऑक्साइड अयस्कों को निस्तापन/भर्जन के द्वारा सांद्रण के उपरांत चुना पत्थर तथा कोक के साथ वाल्या भट्टी (धमन भट्टी) में ऊपर से डाला जाता है।

निस्तापन-अयस्क का निस्तापन किया जाता है जो फेरस ऑक्साइड को फेरिक ऑक्साइड में बदल देता है।
जारण-जारण के द्वारा वाष्पशील अशुद्धि को दूर किया जाता है तथा धातु ऑक्साइड को अपचयित किया जाता है।
4FeO (s) + O2 (g) → 2Fe2O3 (s)
S+O2 (g) → SO2 (g)↑
4As + 3O2 (g) → 2As2O3 (g)↑
वात्या भट्टी (धमन भट्टी) को निचली सतह पर होने वाली अभिक्रिया
C (s) + O2 (g) → CO2 (g)
निचले स्तर का ताप 2170 K होता है।
मध्यम स्तर पर होने वाली प्रतिक्रिया
CaCO3 (s) → CaO (s) + CO2 (g)
CaO (s) + SiO2 → CaSiO3
धातुमल कैल्शियम सिलिकेट
माध्यम स्तर के कोक (C) कार्बन डाइऑक्साइड (CO2) से प्रतिक्रिया करती है तथा कार्बन मोनोऑक्साइड देती है तथा तापमान को गिरा देती है।
C (s) + CO2 (g) → 2CO (g)
वात्या भट्टी के ऊपरी स्तर पर होने वाली प्रतिक्रिया जो तापमान 800 1100 K में होती है।
3Fe2O3 (s) + CO (g) → 2Fe3O4 + CO2 + (g)
Fe3O + CO (g) → 3FeO + CO2 (g)
FeO (s) + CO (g) → Fe (s) + CO2 (g)
कार्बन मोनोऑक्साइड जो मध्यम स्तर में बनता है, अपचायक का कार्य करता है तथा हेमाटाइट से लोहे को पूर्णतः मुक्त कर देता है।
गलित लोहे के ऊपर धातुमल (CaSiog) तैरता रहता है, जिसे निकासी से अलग कर लिए जाता है।
वात्या भट्टी से प्राप्त लोहे में लगभग 40% कार्बन तथा अन्य अशुद्धियाँ जैसे S, P, Si, Mn, सूक्ष्म मात्रा में उपस्थित रहते हैं। यह कच्चा लोहा (Pig iron) के नाम से जाना जाता है।
प्रश्न 2. अमोनिया का औद्योगिक उत्पादन कैसे किया जाता है ?
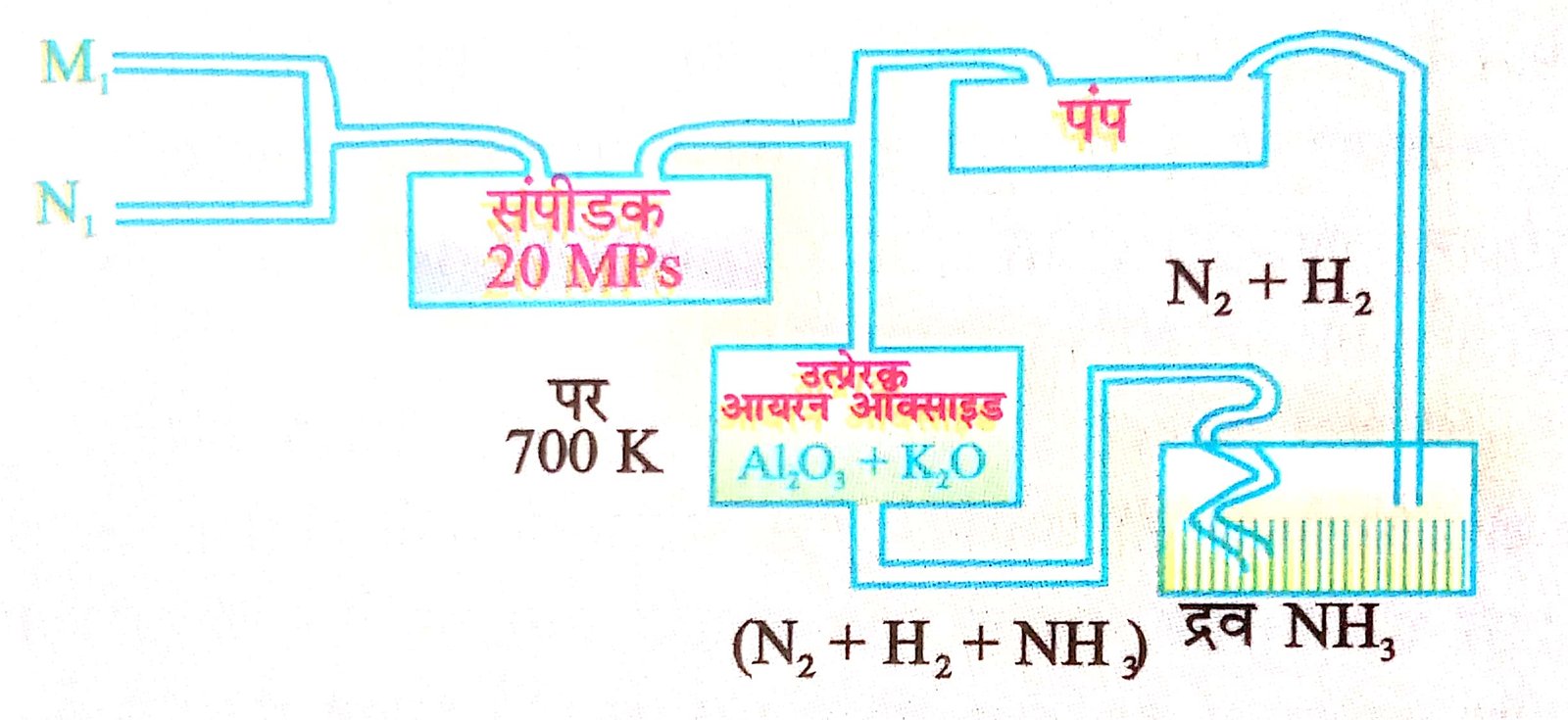
उत्तर⇒ व्यापक स्तर पर अमोनिया हाबर प्रक्रम द्वारा बनाई जाती है।
N2(g) + 3H2(g) 2NH3(g) + 4H2O(I) + Cr2O3
ला-शतैलिए सिद्धान्त के अनुसार उच्च दाब अमोनिया निर्मित करने के लिए अनुकूल होता है। अमोनिया के उत्पादन के लिए अनुकूलतम परिस्थितियाँ 200 x 105 Pa वायुमंडल दाब, 700K ताप तथा थोड़ी मात्रा में K2O तथा Al2O3 युक्त आयरन ऑक्साइड जैसे उत्प्रेरक का उपयोग होता है ताकि साम्य अवस्था प्राप्त करने की दर बढ़ाई जा सके।
प्रश्न 3. (क) ऑक्सीकरण अभिक्रिया से धातु निष्कर्षण कैसे किया जाता है ?
(ख) शोधन से आप क्या समझते हैं ? शोधन में उपयोग कुछ विधियों का वर्णन करें।
उत्तर⇒ (क) विशेषकर अधातुओं का परिष्करण ऑक्सीकरण पर निर्भर करता है।
उदाहरण- ब्राइन से क्लोरीन प्राप्त करना।
2Cl– (aq) + 2H2O → 2OH– (aq) + H2(g) + Cl2(g)
ΔG° = + 422 kJ
जब इसे E° में बदलते हैं तब E = 2.2 volt
वास्तव में यह 2.2 से ज्यादा विभव आवश्यकता होती है लेकिन वैद्युत अपघटन के लिए इस व्यवधान को दूर करने के लिए ज्यादा विभव की आवश्यकता होती है अतः वैद्युत अपघटन द्वारा Cl2 प्राप्त होती है NaOH उपोत्पाद के रूप में NaCl के लिए भी वैद्युत अपघटन किया जाता है। परन्तु इससे Na प्राप्त होता है न कि NaOH सोना-चाँदी आदि का धातु के निक्षालन विधि द्वारा प्राप्त करते हैं। यह भी एक ऑक्सीकरण अभिक्रिया है।
Ag → Ag+ या Au → Au+
4Au(s) + 8CN– (aq) + 2H2O(aq) + O2(g)
→ 4[Au(CN)2]–(aq) + 40H aq
2[Au(CN)2] (aq) + Zn(s) 2Au + (Zn (CN)4]2- (aq)
अभिक्रिया में जिंक अपचायक के रूप में कार्य करता है।
(ख) किसी विधि द्वारा उत्पन्न धातु पूर्ण शुद्ध नहीं होती। पूर्ण शुद्ध धातु प्राप्त करने के लिए विभिन्न विधियों का उपयोग किया जाता है। ये विधियाँ संयुक्त रूप से शोधन विधियाँ कहलाती है। जैसे- (i) आसवन (ii) द्रवगलन (iii) वैद्युत अपघटन (iv) मंडल परिष्करण (v) वाष्प प्रावस्था (vi) वर्णलेखिकी।
प्रश्न 4. हैबर विधि से अमोनिया गैस बनाने के सिद्धान्त को NH3 से HNO3 में परिवर्तन करने के सिद्धांत और समीकरण को लिखिए।
उत्तर⇒ हैबर विधि-
इस विधि में अमोनिया गैस का उत्पादन सीधे नाइट्रोजन गैस और हाइड्रोजन गैस के संयोग से अधिक दाब (लगभग 200 वायु….) और कम तापक्रम (450°C) पर उत्प्रेरक की उपस्थिति में किया जाता है।
N2 + 3H2 ![]() 2NH3 + Qk cal.
2NH3 + Qk cal.
यह ऊष्माक्षेपी आयतन में संकुचन और उत्क्रमणीय रासायनिक प्रतिक्रिया है। इसलिए अमोनिया की अधिकतम मात्रा उच्च दाब, कम तापक्रम पर बन अमोनिया को निकालकर प्राप्त किया जाता है जिससे साम्य की दिशा अग्रगामी हो जाती है।
अमोनिया को नाइट्रिक अम्ल में परिवर्तन-
अमोनिया से नाइट्रिक अम्ल प्राप्त करने के लिए इसे Pt एस्बेस्टस उत्प्रेरक की उपस्थिति में ऑक्सीकरण कराते हैं जिससे नाइट्रीक ऑक्साइड गैस प्राप्त होता है।
4NH3 + 5O2![]() 4NO + 6H2O
4NO + 6H2O
नाइट्रिक ऑक्साइड ऑक्सीजन की अधिकता में NO2 में परिवर्तित होता है जो जल से प्रतिक्रिया कर HNO3 अम्ल बनाता है।
2NO2 + O2 → 2NO2
3NO2 + H2O → 2HNO3 + NO
प्रश्न 5. धातु का नाम बतायें जो निम्न अयस्कों से प्राप्त होते हैं
(a) क्रायोलाइट (b) डोलोमाइट (c) कालामाइन (d) हेमाटाइट (e) मैलाकाइट।
उत्तर⇒ अयस्क – धातु
(a) क्रायोलाइट – ऐल्युमिनियम
(b) डोलोमाइट – कैल्सियम या मैग्नीशियम
(c) कालामाइन – जिंक
(d) हेमाटाइट – लोहा
(e) मैलाकाइट – कॉपर।
प्रश्न 6. धातुओं के निष्कर्षण (extraction of metals) के झाग उत्प्लावन विधि वर्णन करें।
उत्तर⇒ झाग प्लवन विधि (Froth Floatation process)-यह विधि सल्फाइड अयस्कों के सान्द्रण (concertation) के लिए विशेष रूप से उपर्युक्त हैं यह विधि अशुद्धियों के कणों (Gangue Particles) एवं अयस्क की जल एवं तेल के साथ गीले होने की विशेषता पर आधारित है। अयस्क तेल के साथ एवं गैंग कण पानी से गीला होता है। सल्फाइड अयस्क को चूर्ण करके जल से क्रिया करवाई जाती है। इससे एक लेई (Paste or Slurry) बनती है। इसको एक टैंक में डालकर जल मिलाया जाता हैं एक दूसरा पदार्थ ग्राही (Collector) जैसे पोटेशियम ऐथिलजेन्ट (Potassium Ethyl Xanthate) या एमिल जेन्थेट (Amyl Xanthate) इसमें मिलाया जाता है। टैंक की सामग्री को यान्त्रिक विलोडक (Mechanical Stirrer) एवं हवा के द्वारा कम दाब पर हिलाया जाता है। अयस्क के कण नीचे स्थित अयस्क की जलीय लेई (Aqueous Pulp) में स्थित वायु के बुलबुलों
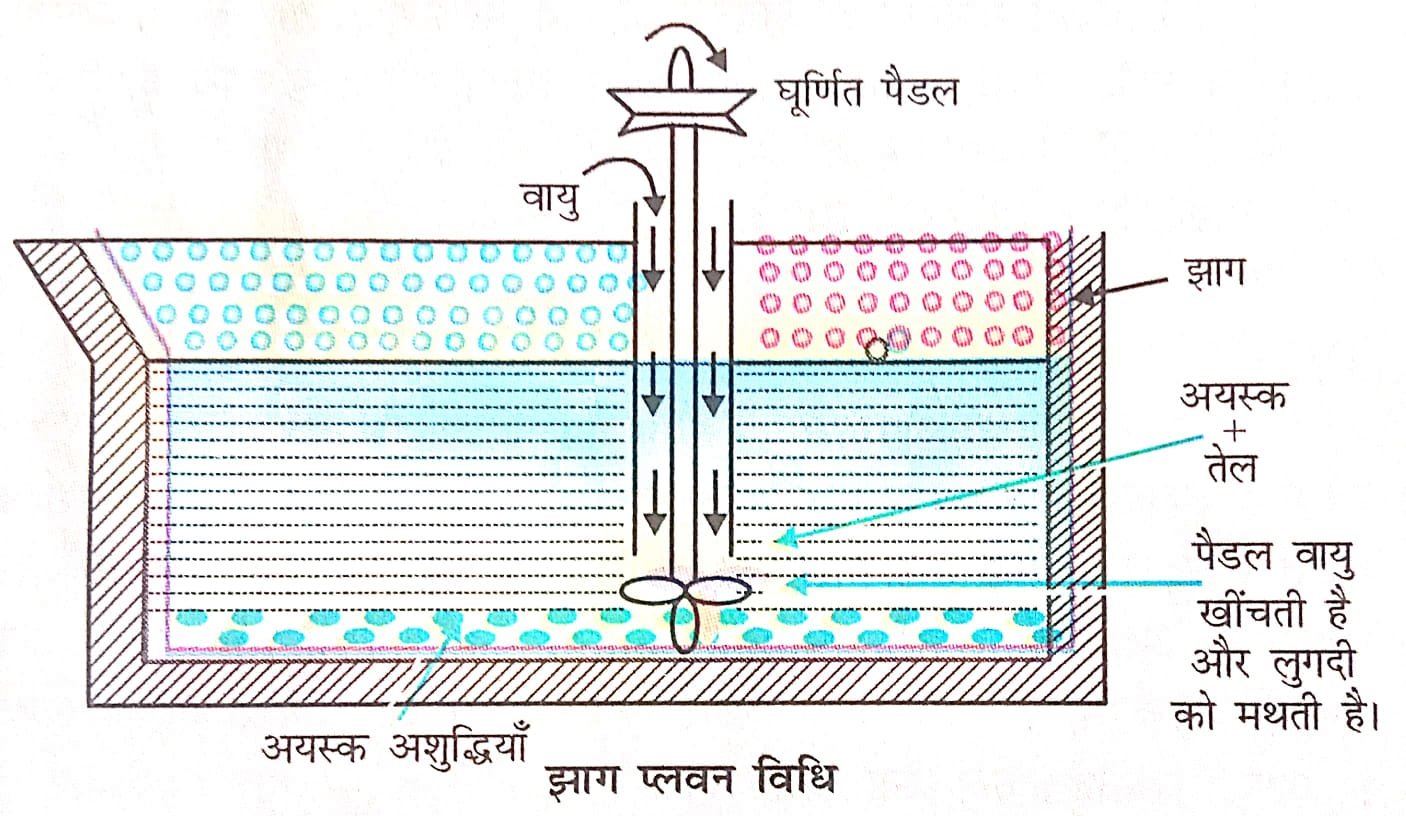
(Bubbles) से जुड़ जाते हैं एवं सतह पर तैरते रहते हैं। यहाँ से इन तैरने वाले झागों को अलग किया जा सकता है। गैंग कण, जो तीव्रता से जल कणों के साथ जुड़े रहते हैं, टैंक के पेंदे (Bottom) में बैठ जाते हैं। इनको बाद में अलग कर लिया जाता है। झाग (Froth) को दूर कर लिया जाता है। इससे सान्द्रित अयस्क (Concentrated Ore) प्राप्त किया जाता है। अयस्क जैसे कॉपर पाइराइट्स (CuFeS2) गैंलेना (PbS) एवं जिंक ब्लैंड (ZnS) को इस विधि द्वारा शुद्ध किया जाता है।
प्रश्न 7. चुम्बकीय सान्द्रण विधि का वर्णन करें।
उत्तर⇒ चुम्बकीय सान्द्रण (Magnetic Concentration)-यह विधि लौह चुम्बकीय अयस्कों (Ferromagnetic Ores) जैसे लोहा, टिनस्टोन, वचोल्फार्म (Wolfarm) आदि के लिए प्रयुक्त की जाती है; जब खनिज तो चुम्बक (Magnet) से आकर्षित होता है लेकिन गैंग (Gangue) नहीं।
इस विधि को प्रयोग चुम्बकीय अशुद्धियों में से अयस्क के पृथक्करण के लिए किया जाता है। पिसे हुए अयस्क को दो चक्क (Rollers) के ऊपर घूमने वाली बेल्ट पर डाला जाता है। दो चक्कों में से एक चुम्बकीय होता है। जैसे ही अयस्क विद्युतचुम्बकीय चक्का (Electromagnetic Roller) के ऊपर से गुजरता है, अचुम्बकीय (non magnetic) अयस्क नीचे गिर जाते हैं एवं चुम्बकीय अशुद्धियाँ पहिया (Magnetic Roller) से आकर्षित होकर उससे चारों ओर घूमती रहती है। जब चुम्बकीय आकर्षण बल खत्म हो जाता है तो अशुद्धि एक ग्राही (Collector) में इकट्ठी हो जाती है। टिनस्टोन अयस्क में उपस्थित चुम्बकीय अशुद्धि वोलफ्रेमाइट (FeWO4) को इस विधि द्वारा पृथक किया जाता है।

प्रश्न 8. निम्नलिखित पर टिप्पणी लिखें :
(i) निस्तापन (Calcination) (ii) जारण (Roasting)
उत्तर⇒ (i) निस्तापन (Calcination)-वायु की अनुपस्थिति में इसके गलनांक से नीचे उच्च ताप पर गर्म करने की क्रिया निस्तापन कहलाती है। यह जलयोजित((Hydrated) अयस्कों के लिए प्रयुक्त की जाती है। इस प्रक्रिया के द्वारा (a) नमी दूर हो जाती है। (b) गैसें बाहर निकलती है। (c) वाष्पशील अशुद्धियाँ दूर हो जाती है (d) समस्त पदार्थ छिद्रयुक्त (Porous) हो जाता है ! (e) अयस्क का तापीय विघटन (Thermal Decomposition) होता है।
जैसे—(a) CaCO3 (लाइमस्टोन) → CaO + CO2
(b) ZnCO3 – (कैलेमाइन) → (मिलावट) →
2FeO3.3H2O (लिमोनाइट) → 2Fe2O3 + 3H2O CuCO3.Cu(OH)2 (मेलेकाइट) → 2CuO + H2O + CO2
निस्तापन परवर्त्तनी भट्टियों (Reverberatory Furnace) में किया जाता है।
(ii) जारण(Roasting)-अकेले अयस्क या अयस्क में उपर्युक्त पदार्थ मिलाकर इसके गलनांक से नीचे वायु के आधिक्य (Excess) में उच्च ताप पर गर्म करने की क्रिया जारण कहलाती है। भर्जन परावर्तन भट्टी या वात्या भट्टी (Blast Furnace) में किया जाता है। जारण में (a) वाष्पशील अशुद्धियों (Voltatile Impurities) जैसे S, As, Sb आदि ऑक्सीकृत होकर SO2, As2O3 एवं Sb2O3 आदि गैसों के रूप में मुक्त हो जाती है।
(b) सल्फाइड अयस्क उनके ऑक्साइडों में विघटित होकर SO2 मुक्त करते हैं। (c) नमी दूर हो जाती है। (d) समस्त पदार्थ छिद्रयुक्त (Porous) हो जाता है एवं यह आसानी से अपचयित हो सकता है। जारण कई प्रकार का हो सकता है-
(a) ऑक्सीकारक जारण (Oxidising Roasting), (b) वात्य जारण (Blast Roasting), (c) अपचायक जारण (Reducing Roasting), (d) सल्फेट जारण (Sulphate Roasting), (e) क्लोराइड जारण (Chlorodising Roasting)।
प्रश्न 9. निम्नलिखित पर टिप्पणी लिखें : (i) प्रगलन (Smelting) (ii) अपचयन (Reduction)
उत्तर⇒ (i) प्रगलन (Smelting)-प्रगलन वह प्रक्रिया है जिसमें अयस्क को गालक (Flux) एवं अपचायक पदार्थ के साथ पिघलाया जाता है। प्रगलन क्रिया सामान्यतः कोयले को जलाकर या विद्युत ऊर्जा द्वारा उच्च ताप उत्पन्न करके वात्या भट्टी (Blast Furnace) में सम्पन्न की जाती है।
अगलनीय अशुद्धि (Infusible Impurity) धातुमल में परिवर्तित हो जाती है एवं इसे हटा लिया जाता है।
CaO + SiO2 → CaSiO3
गालक आधात्री धातुमल
(Flux) (Cangue) (Slag)
FeO + SiO2 → FeSiO3
आधात्री गालक धातुमल
(Cangue) (Flux) (Slag)
परन्तु घोल में CO2 गैस देर तक प्रवाहित करने से चूना जल का दुधियापन समाप्त हो जाता है और पुनः स्वच्छ घोल प्राप्त होता है। ऐसा कैल्शियम बाइकार्बोनेट के बनने के कारण होता है जो जल में घुलनशील है।
CaCO3 + H2O + CO2 = Ca (HCO3)2 (घुलनशील)
SO2 गैस के साथ ‘चूना जल परीक्षा करने पर भी पहले घोल का रंग दुधिया हो जाता है परन्तु देर तक SO2 गैस प्रवाहित करने पर पुनः स्वच्छ घोल प्राप्त होता है।
Ca(OH)2 + SO2 = CaSO3 ↓ + H2O
(दुधिया अवक्षेप)
CaSO3 + H2O + SO2 = Ca(HSO3)2 (घुलनशील)
इन्हीं कारणों से CO2 और SO2 को पहचानने में भूल हो जाती है। पोटैशियम डाइक्रोमेट या पोटैशियम परमैंगनेट के जलीय घोल से इनकी जाँच करके इनमें अन्तर किया जा सकता है।
SO2 गैस को तनु अम्लीकृत पौटेशियम डाइक्रोमेट के नारंगी रंग के विलयन में प्रवाहित करने पर इसका रंग परिवर्ति होकर हरा हो जाता है।
K2Cr2O7 + H2SO4 + 3SO2 → K2SO4 + Cr2(SO4)3 + H2O, CO2
(नारंगी) (हरा)
गैस यह परीक्षण नहीं देती है।



